銅と濃硝酸、その化学反応と実験

銅と濃硝酸は、日常生活において頻繁に遭遇する二つの物質です。銅は、電気・電子部品や建築材料など、様々な分野で利用されています。一方、濃硝酸は、研究室や工業現場において、酸化剤や触媒として重要な役割を担っています。両者を合わせた銅と濃硝酸の化学反応は、非常に激しく、爆発的な反応を引き起こすことがあります。このような化学反応を、実験的に捉えることで、我々は新しい科学的知見を獲得することができます。本稿では、銅と濃硝酸の化学反応と実験について、詳しく紹介します。
銅と濃硝酸、その化学反応と実験
銅と濃硝酸との化学反応は、非常に重要な化学反応の一つです。この反応では、銅が濃硝酸と反応して、 硝酸銅 を生成します。この反応は、化学の基礎的知識として学習されるだけでなく、実際の実験でも重要な役割を果たします。
銅と濃硝酸の反応式
銅と濃硝酸の反応式は、次のようになります。
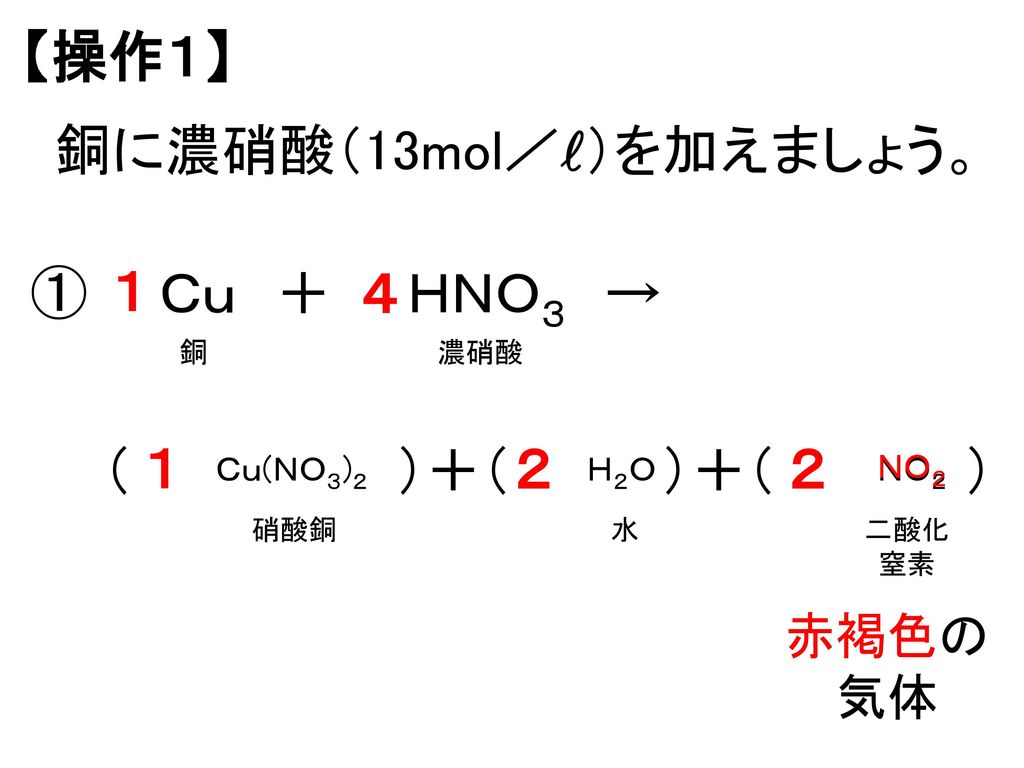
キスマイフット2の意味、その由来とファンの声Cu + 4HNO₃ → Cu(NO₃)₂ + 2NO₂ + 2H₂O
この反応式では、銅が濃硝酸と反応して、硝酸銅と二酸化窒素、水を生成します。
銅の酸化状態の変化
銅と濃硝酸の反応では、銅の酸化状態が変化します。銅は、 零価 から 二価 に酸化状態が変化します。この酸化状態の変化は、銅の化学的性質を変化させる要因の一つです。
濃硝酸の役割
濃硝酸は、銅と濃硝酸の反応では、 酸化剤 の役割を果たします。濃硝酸は、銅を酸化して、硝酸銅を生成するために必要不可欠な物質です。
実験の注意点
銅と濃硝酸の反応の実験では、 安全性 を最優先に考慮する必要があります。濃硝酸は、 毒性 が強く、皮膚や目に毒性があるため、実験中は、 防護具 を着用する必要があります。
反応の応用
銅と濃硝酸の反応は、実際の応用において非常に重要です。例えば、 電子部品 の製造において、硝酸銅は、重要な材料の一つです。また、 環境浄化 では、銅と濃硝酸の反応を利用して、水の浄化を行うことができます。
銅と濃硝酸の化学反応式は?
銅と濃硝酸の化学反応式は、Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2O である。
反応のメカニズム
銅と濃硝酸の反応は、酸化還元反応である。銅が酸化されてCu²⁺イオンになり、濃硝酸は還元されてNO₂ガスと水になる。
反応の条件
この反応には、濃硝酸を使用することが必要である。希硝酸では反応が進行しない。加えて、高温や触媒の存在も反応速度を上げる効果がある。
生成物の性質
生成物であるCu(NO₃)₂は、青色の結晶であり、水に溶けることによる溶液を形成する。NO₂ガスは赤褐色を示し、毒性が高い。
応用分野
銅と濃硝酸の反応は、工業化学や環境科学に応用される。銅イオンの検出や、廃棄物処理におけるNO₂ガスの除去など、多くの分野で重要な反応である。
安全対策
この反応を行う際には、安全ゴーグルや防護服を着用し、換気を十分に行う必要がある。濃硝酸は腐食性が高く、人体や設備に対する危険を伴うためである。
銅と濃硝酸を反応させるとどんな気体が発生しますか?

銅と濃硝酸を反応させると、二酸化窒素ガスが発生します。この反応は、銅が濃硝酸によって酸化されることで起こります。
反応の式
銅と濃硝酸の反応式は、Cu + 2HNO₃ → Cu(NO₃)₂ + H₂O + NO₂ となります。この式より、銅が濃硝酸によって酸化されて、二酸化窒素ガスが発生することがわかります。
反応の機構
この反応は、銅の酸化と同時に、濃硝酸の還元が起こります。銅が酸化されることで、電子が奪われ、二酸化窒素ガスが生成されます。一方、濃硝酸は還元されて、水と二酸化窒素ガスに分解されます。
発生するガスの特徴
- 二酸化窒素ガスは、赤褐色の気体です。
- このガスは、毒性があり、人体に有害です。
- また、二酸化窒素ガスは、酸雨の原因となりえるため、環境にとっても問題があります。
実験の注意点
この反応を行う際には、二酸化窒素ガスが発生するため、換気のよい場所で行う必要があります。また、濃硝酸は強酸であるため、取り扱いに注意する必要があります。
応用
この反応は、工業的な応用では、銅の製錬や、二酸化窒素ガスの生成に用いられます。また、試験管内での反応でも、二酸化窒素ガスを検出するための実験として行われます。
銅と硝酸を反応させると何ができますか?

銅(Cu)は、硝酸(HNO3)と反応して、銅イオン(Cu2+)と硝酸塩を生成する。この反応は、酸化剤としての硝酸の性質に基づいており、銅を酸化させることで、硝酸塩を生じる。
反応の式
銅と硝酸の反応の式は、次のようになる。
- Cu + 2HNO3 → Cu(NO3)2 +
- Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2O
生成物の性質
この反応で生成する銅イオン(Cu2+)と硝酸塩(Cu(NO3)2)は、両方とも水に溶け、blue-green色を示す。硝酸塩は、強い酸化剤としての性質を持ち、多くの金属を酸化させることができる。
実験的な考察
実験的に、この反応を実現するためには、銅を硝酸に漬け込むか、硝酸を銅に滴下することが必要である。反応が進行するにつれて、青緑色の硝酸塩が生成し、硝酸の濃度が低下する。
応用例
この反応は、工業的には、銅の精錬や、硝酸塩の製造などに応用される。また、分析化学の分野では、銅の検出や、硝酸塩の検出に用いられる。
安全対策
この反応には、硝酸や銅イオンが含まれるため、危険性が高い。実験を行う際には、防護具を着用し、換気設備を整備することが必要である。
銅は硝酸に溶けますか?

銅は、硝酸には溶けません。硝酸は強酸であり、銅はそのような酸に対して耐久性がありません。銅が硝酸に曝露されると、銅イオンが生成され、銅の表面が腐食されます。
銅と硝酸の反応
銅と硝酸が反応すると、銅イオンと硝酸イオンが生成されます。この反応は、酸化還元反応の一種です。
- 銅イオンの生成:銅が硝酸に曝露されると、銅イオンが生成されます。
- 硝酸イオンの生成:硝酸が銅に反応すると、硝酸イオンが生成されます。
- 腐食の進行:銅イオンと硝酸イオンが生成されると、銅の表面が腐食されます。
銅の耐久性
銅は、硝酸に対して耐久性がありません。強酸である硝酸に対して、銅は劣化します。
- 銅の腐食:銅が硝酸に曝露されると、銅の表面が腐食されます。
- 銅イオンの生成:銅が硝酸に曝露されると、銅イオンが生成されます。
硝酸の危険性
硝酸は、強酸であり、人体や環境に対して危険を及ぼす可能性があります。
- 皮膚の灼傷:硝酸に触れると、皮膚が灼傷します。
- 眼の損傷:硝酸が眼に飛び込むと、眼が損傷します。
- 環境汚染:硝酸は、環境に悪影響を及ぼす可能性があります。
銅の利用
銅は、電気や電子部品、建築材料など、多くの分野で利用されます。
- 電気部品:銅は、電気抵抗が小さいため、電気部品に広く利用されます。
- 電子部品:銅は、電子部品に広く利用されます。
- 建築材料:銅は、建築材料として、建物の外装や内装に利用されます。
硝酸の利用
硝酸は、化学合成や研磨剤など、多くの分野で利用されます。
- 化学合成:硝酸は、化学合成に利用されます。
- 研磨剤:硝酸は、研磨剤として、金属や石材の研磨に利用されます。
- 分析化学:硝酸は、分析化学に利用されます。
詳しくは
銅と濃硝酸の化学反応は何ですか?
銅と濃硝酸の化学反応は、酸化還元反応の一種です。この反応では、銅が酸化され、濃硝酸が還元されます。この反応は、銅の表面で起こり、NO₂ガスが生成されます。この反応は、実験室で行うことができ、実験の結果、銅が緑色に変化することを確認することができます。
銅と濃硝酸の反応速度は何ですか?
銅と濃硝酸の反応速度は、濃度や温度によって異なります。一般に、濃硝酸の濃度が高く、温度が高いほど、反応速度は速くなります。また、銅の表面状態も反応速度に影響を与えます。例えば、銅の表面が研磨されている場合、反応速度は速くなります。一方、銅の表面が酸化皮膜で覆われている場合、反応速度は遅くなります。
銅と濃硝酸の反応は危険ですか?
銅と濃硝酸の反応は、危険です。この反応では、NO₂ガスが生成されますが、このガスは毒性が強く、人体に有害です。また、この反応では、爆発の危険もあります。したがって、実験を行う際には、安全保護具を着用し、換気を十分に行う必要があります。
銅と濃硝酸の反応は実際に使われている場所はどこですか?
銅と濃硝酸の反応は、工業や研究の分野で広く使われています。例えば、電池の製造过程で、銅と濃硝酸の反応が使われています。また、環境浄化の分野でも、この反応が使われています。例えば、廃水処理では、銅と濃硝酸の反応を用いて、水中の窒素酸化物を除去しています。